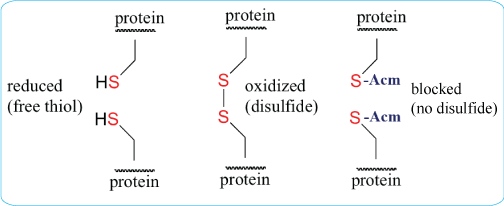
多肽合成:二硫键形成

二硫键是很多蛋白质立体结构中不可或缺的组成部分。我们几乎可以在所有的胞外肽类和蛋白质分子中发现这些共价键。当一个半胱氨酸的硫原子与位于蛋白质不同位置的另一半胱氨酸的硫原子形成共价单键时,一个二硫键就形成了。这些键有助于稳定蛋白质,特别是那些从细胞中分泌的蛋白质。
一个二硫键的有效形成涉及多方面,包括对半胱氨酸的恰当管理、对该氨基酸残基的保护、保护基团的脱除方法和配对方法等。
如果多肽中只含有1对Cys,那二硫键的形成是简单的。多肽经固相或液相合成,然后在pH8-9的溶液中进行氧化。
当需要形成2对或2对以上的二硫键时,合成过程则相对复杂。尽管二硫键的形成通常是在合成方案的最后阶段完成,但有时引入预先形成的二硫化物是有利于连合或延长肽链的。使用最广泛的Cys的保护基团有Bzl、Meb、Mob、tBu、Trt、Tmob、TMTr、 Acm、Npys等。
S-acetomidomethyl(Acm)在酸和碱中都非常稳定,因此,Acm与Boc和Fmoc化学成份都是兼容的。一些保守的半胱氨酸残基对蛋白-蛋白结合和蛋白-蛋白相互作用至关重要。部份研究利用Ala替换Cys来破坏二硫键结构。另外还可以利用Acm修饰Cys,这种修饰会阻止二硫键的形成,同时还保持蛋白中Cys的结构。
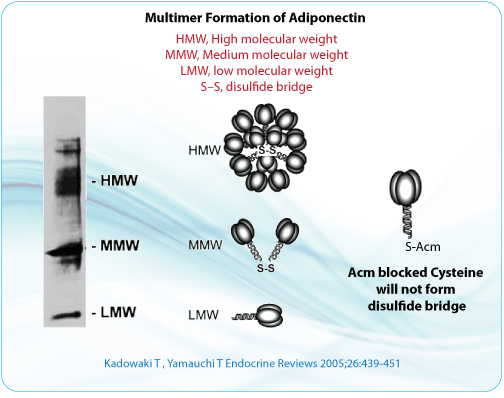
S- Acm经溶液如醋酸汞((Hg[OAc]2)在pH 4.0的缓冲液中处理1h后可被去除,从而可获得自由巯基。或被S-Acm-阻断的多肽可以在苯甲醚存在下,以TFA作为溶剂,经三氟甲烷磺酸银在0℃处理1h。而在固相合成过程中,当多肽仍然锚定在支撑物上时,经Hg(OAc)2 (0.06M)在DMF中于20℃避光条件反应3小时即可,随后用DMF和DMF-β-巯基乙醇(9:1,v/v)洗涤,将Hg2 +从被解块的肽-树脂中去除。
为什么半胱氨基(Cys)如此特殊?
- Cys的侧链有一个非常活跃的反应性巯基。此基团中的的氢原子可很容易地被自由基和其他基团取代,因而易与其他分子形成共价键。
- 二硫键是许多蛋白质三维结构中的重要组成部分。二硫桥键可降低肽的弹性、增加刚度,并减少潜在构象的数量。这样的构象限制对生物活性和结构稳定性来说是至关重要的。它的替换对蛋白质的整体结构来说将可能是戏剧性的。
- 疏水性氨基酸如Leu、Ile、Val是螺旋的稳定剂。因为即使半胱氨酸没有形成二硫键也可以使α螺旋稳定。即如果所有的半胱氨酸残基处于还原态(-SH,携带自由巯基),高百分比的螺旋片段将有可能。
- 半胱氨酸形成的二硫键对三级结构的稳定来说是持久的。在大多数情况下,键间的S-S桥对形成四级结构是必须的。有时形成二硫键的半胱氨酸残基在一级结构中相距甚远。
- 二硫键的拓扑是分析蛋白质一级结构同源性的基础。位于同源蛋白的半胱氨酸残基是非常保守的。仅色氨酸在统计学上比半胱氨酸更为保守。
- 半胱氨酸位于巯基酶催化部位的中心。半胱氨酸可直接与底物形成酰基中间体。还原形态作为“巯基缓冲器”维持着蛋白中的半胱氨酸处于还原态。在低的pH值时,平衡偏向还原态,-SH形式,而在碱性环境下,-SH更倾向于被氧化,形成-SR,而 R是除氢原子外的任何物质。
- • 半胱氨酸也可作为解毒性与过氧化氢和有机过氧化物反应。
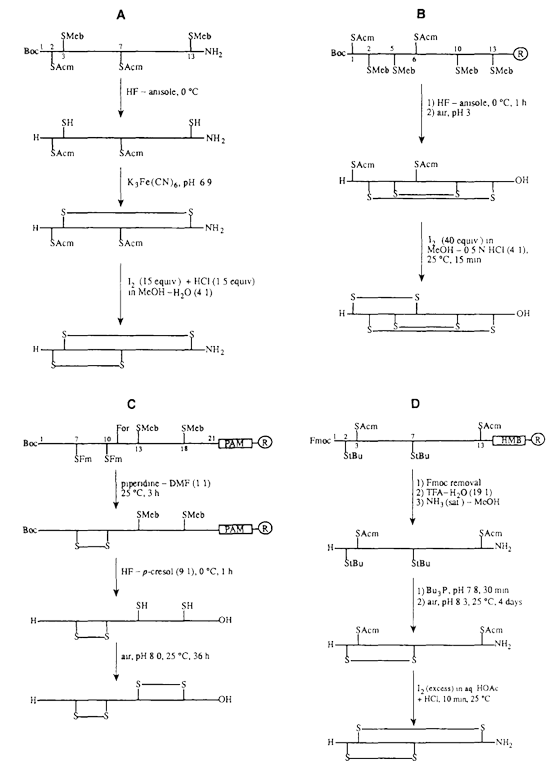
多重二硫键形成方案
报价
- 方法 1: 在线报价系统:

|



